FDA核准Osilodrostat (Isturisa®) 用於成人庫欣氏症病患

美國FDA於2020年03月06日核准了第一個用於庫欣氏症的類固醇生成抑制劑Osilodrostat (Isturisa®),機轉是藉由抑制11‐beta‐hyrdoxylase (CYP11B1),阻斷腎上腺類固醇合成的步驟,讓皮質醇分泌正常化。

庫欣氏候群屬於一種糖皮質素分泌( glucocorticoid )過多內分異常疾病,若沒有適當治療會增加心血管與腦血管疾病的風險以及糖尿病、感染、憂鬱等等疾病發生率。 Cushing's syndrome先藉由Glucocorticoid來源分成外源性(Exogenous)與內源性(Endogenious),內源性又可以細分為促腎上腺皮質激素依賴性(ACTH-dependent) 與 非促腎上腺皮質激素依賴性(ACTH-independent)。
- ACTH依賴型病因:腦下垂體ACTH腫瘤或異位性ACTH症
- 非ACTH依賴型病因:腎上腺腫瘤、PPNAD、AIMAH等等
- 外源性的Cushing's syndrome病因:長期過度使用含醣皮質素藥物
PPNAD = 原發性色素結節腎上腺皮質症 (primary pigmented nodular adrenocortical disease);AIMAH = ACTH-不依賴型腎上腺巨結節增生 (ACTH-independent macronodular adrenal hyperplasia).
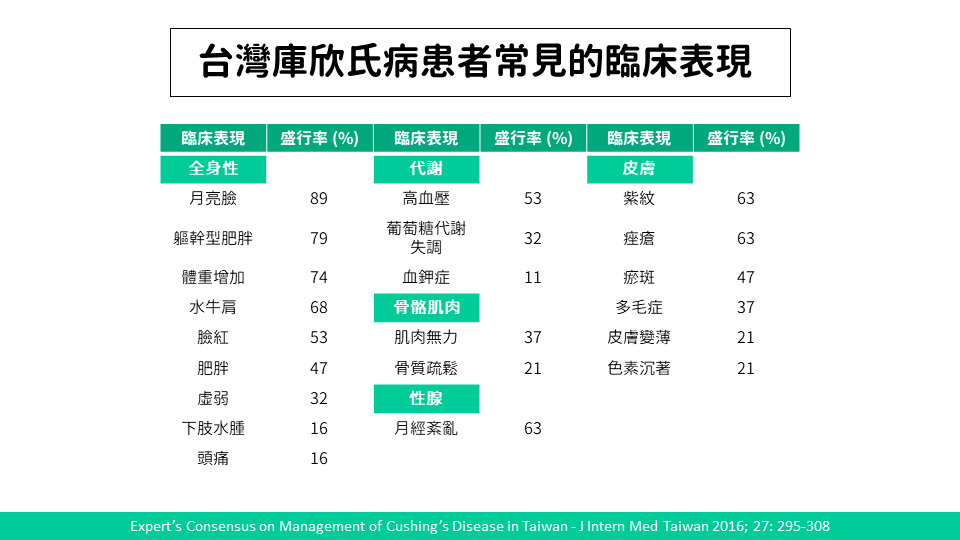
流行病學部分由於類固醇藥物在現代醫療的使用增加,根據研究幼兒與成人庫欣氏症患者病因多為外源性,至於內源性則屬於罕見疾病,發生率每年 0.7-2.4 人 / 每百萬人,常見臨床表現如下表;
治療選擇首選為手術,但若病人對手術的治療反應欠佳或無法手術時可考慮藥物或放射治療。藥物治療部分台灣目前核准的成分是pasireotide ( SIGNIFOR®),其他國外用來治療庫欣氏症的藥物如下表:

本次FDA核准的Osilodrostat (Isturisa®),機轉與上述藥物不同,藉由抑制11‐beta‐hyrdoxylase (CYP11B1),直接阻斷腎上腺類固醇合成的步驟。
適應症:Isturisa®是一種類固醇生成抑制劑,用於無法接受手術或手術無法治癒的成人庫欣氏症病患。治療前應先矯正病患低血鉀與低血鎂並監測心電圖。
劑量:
- 起始劑量:2mg BID
- 劑量調整:1-2mg every 2 week,觀察病患耐受性與疾病改善狀況,最高劑量30mg BID。
肝腎功能調整:
- 腎功能無劑量調整建議
- 依照肝功能分級
- Child-pughs A 無須調整劑量
- Child-pughs B 起始劑量 1mg BID
- Child-pughs C 起始劑量 1mg QD (傍晚服用)
常見不良反應* (>15%):
Adrenal insufficiency¶ 腎功能不全 (43.1%), Fatigue (38.7%), Nausea (37.2%), Headache (30.7%), Edema (21.2%), Nasopharyngitis 鼻咽炎 (19.7%), Vomiting (19%), Arthralgia 關節痛 (17.5%), Back pain (15.3%)
*根據48-week clinical study in cushing's disease研究
¶包含glucocorticoid deficiency, adrenocortical insufficiency acute, steroid withdrawal, cortisol free urine decreased, cortisol decrease
Warnings and precautions:
- Hypocortisolism (監測病患皮質醇缺乏及腎上腺功能不全造成的生命威脅,考慮進行劑量調整)
- QTc prolong (監測病患心電圖)
- Adrenal hormone precursors與Androgens上升,監測低血鉀、高血壓惡化、水腫、多毛症
藥物交互作用:
- Strong CYP3A4 inhibitor (Ex. Itraconazole, Clarithromycin) may cause an increase in osilodrostat concentration and may increase the risk of ISTURISA-related adverse reactions. Reduce the dose of ISTURISA by half with concomitant use of a strong CYP3A4 inhibitor.
- Concomitant use of ISTURISA with strong CYP3A4 and/or CYP2B6 inducers (e.g., carbamazepine, rifampin, phenobarbital) may cause a decrease in osilodrostat concentration and may reduce the efficacy of ISTURISA. During concomitant use of ISTURISA with strong CYP3A4 and CYP2B6 inducers, monitor cortisol concentration and patient's signs and symptoms. An increase in ISTURISA dosage may be needed.
特殊族群:
哺乳 - 服用Isturisa®一週內不建議哺乳
藥物動力學:
- Time to peak (Tmax):1 Hour
- 分布體積:100 L
- 蛋白質結合率:36.4%
- 排除半衰期:4 Hours
- 代謝:CYP enzymes & UDP-glucuronosyltransferases
- 排除路徑:尿液(90.6%)、糞便(1.58%)
參考資料:
內科學誌 - 庫欣氏病之診治:台灣專家共識 DOI:10.6314/JIMT.2016.27(6).02
其他文章:
Galcanezumab | Emgality 一個月給藥一次的偏頭痛藥物





 留言列表
留言列表

